- L’institut
- Un nouvel Institut Hospitalo-Universitaire
- Programme médico-scientifique
- Histoire de l’hématologie sur le campus de Saint-Louis
- Gouvernance de l’Institut
- Espace presse
- Nous contacter
- Notre actualité
- Portrait de Valéria Bisio, chargée de recherche
- Création d’une unité d’hémato-oncogénétique
- Portrait d’Alice Gros, patiente pair-aidante
- Lauréats du premier appel à projet de l’Institut de la Leucémie
- Portrait de Julien Calvo, chercheur
- Nous soutenir
- Nous rejoindre
- Vous êtes
- Patients et proches
- Être soigné et accompagné
- Nos services cliniques
- Nos soins de support
- Traitements anti-cancéreux
- Notre recherche clinique sur les leucémies
- Devenir patient expert
- Découvrir l’Institut
- Chercheurs
- Recherche
- Essais cliniques
- Découvrir l’Institut
- Professionnels de la santé
- Adresser un patient
- Notre recherche clinique
- Découvrir l’Institut
- Un nouvel Institut pour la lutte contre la leucémie
- Histoire de l’hématologie sur le campus de Saint-Louis
- Industriels
- Découvrir l’Institut
- Recherche translationnelle
- Donateurs
- Nous soutenir
- Découvrir l’Institut
- Soin
- Prise en charge des patients
- Etre soigné à l’Institut de la Leucémie
- Traitements anti-cancéreux
- Soins de support
- Réunions de concertation pluridisciplinaires ouvertes
- Nos services cliniques
- Hôpital Saint-Louis – Service Hématologie Adultes
- Hôpital Saint-Louis – Service Hématologie Greffe
- Hôpital Saint-Louis – Service de Pharmacologie et Investigations Cliniques
- Hôpital Saint-Louis – Service Adolescents Jeunes Adultes
- Hôpital Saint-Louis – Unité ambulatoire d’hémato-oncogénétique
- Hôpital Saint-Louis – Service Hématologie Séniors
- Hôpital Robert-Debré – Service d’Hématologie et immunologie pédiatrique
- Hôpital Necker – Service d’Hématologie Adulte
- Hôpital Cochin-Port Royal – Service Hématologie Clinique
- Hôpital Avicenne – Service Hématologie Clinique et Thérapie Cellulaire
- Nos laboratoires de biologie médicale
- Laboratoire d’hématologie biologique, Michaela Fontenay
- Laboratoire d’hématologie biologique, Jean Soulier
- Unité fonctionnelle de génétique moléculaire, Hélène Cavé
- Laboratoire d’hématologie biologique, Vahid Asnafi
- Informations pour les patients
- Leucémies Aiguës Myéloïdes
- Leucémies Aiguës Lymphoïdes
- Néoplasies Myéloprolifératives
- Syndromes Myélodysplasiques
- Traitements anti-cancéreux
- Soins de support
- Accompagnement des patients atteints de leucémies
- Recherche
- Nos équipes de recherche
- Equipe de Hugues de Thé – Pathologie Moléculaire
- Equipe de Raphael Itzykson – Médecine de précision fonctionnelle des leucémies
- Equipe de Michaela Fontenay – Hématopoiese normale et pathologique
- Equipe de Françoise Pflumio – Niche, cancer et radiation dans l’hématopoïèse
- Equipe de Sylvie Méléard – Evolution de populations et système d’interactions de particules
- Equipe de David Michonneau – Immunologie translationelle en immunothérapie et hématologie
- Equipe de Lina Benajiba – Identification et ciblage des régulateurs extrinsèques des hémopathies myéloïdes
- Equipe de Karl Balabanian – Niches lymphoïdes, chimiokines et syndromes immuno-hématologiques
- Equipe d’Alexandre Puissant – Bases moléculaires du développement des leucémies aiguës myéloïdes
- Equipe de Stéphane Giraudier – Hémopathies myéloïdes chroniques, microenvironnement & recherche translationnelle
- Equipe de Diana Passaro – Leucémie et dynamiques de la niche
- Equipe de Camille Lobry – Contrôle génétique et épigénétique de l’hématopoïèse normale et maligne
- Equipe de Jean Soulier – Aplasie et leucémies secondaires
- Equipe de Sylvie Chevret – Biostatistiques et épidémiologie clinique
- Nos plateformes technologiques
- Notre recherche clinique sur les leucémies
- Participer à un essai clinique
- Portail de transparence
- eTHEMA : La cohorte des patients atteints de leucémies
- Enseignement
Accueil Premier centre de recherche contre la leucémie en France Equipe de Hugues de Thé – Pathologie MoléculaireEquipe de Hugues de Thé – Pathologie Moléculaire
...Hugues de Thé
Chef d’équipe
Institut de recherche Saint-Louis

Thématiques de recherche
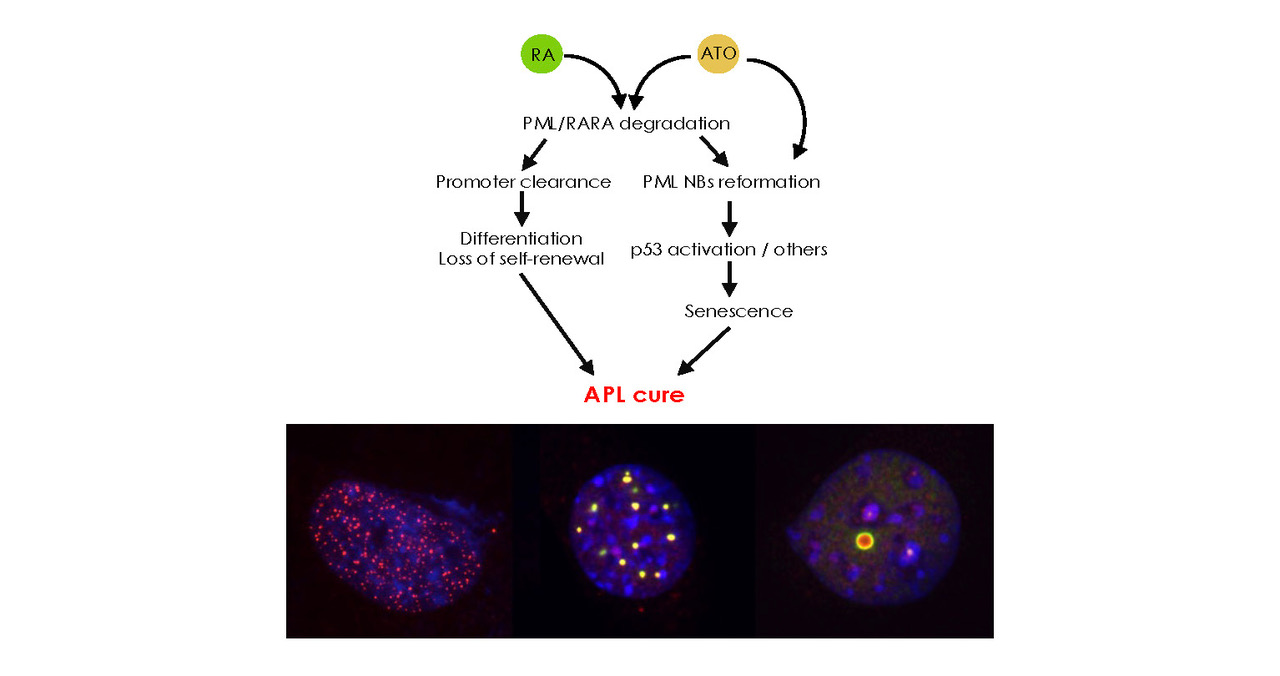
Notre équipe cherche à décrypter les mécanismes cellulaires et moléculaires de la réponse thérapeutique des leucémies aigües myéloïdes. Notre modèle de prédilection est la réponse de la leucémie aigües promyélocytaire à l’acide rétinoïque et l’arsenic. Des travaux récents se concentrent sur la réponse à la chimiothérapie conventionnelle.
Axes de recherche
Nous avons démontré que Pml contrôle la sumoylation, couplant celle-ci aux stress oxydants. Par ailleurs, la protéine Pml normale est indispensable à la réponse des LAP induites par l’expression de la fusion PML/RARA. Des travaux en voie de publication montrent que Pml est également important pour la réponse à la chimiothérapie conventionnelle, via le contrôle de la sénescence. Dans ces deux modèles, nous explorons les relations structure/fonction de Pml (site de détection du redox, sites de sumoylation…).
Dans la LAP, la réponse thérapeutique nécessite la présence de Pml, mais l’initiation de la maladie est liée à l’interférence avec la signalisation de RARA. Effectivement, des maladies proches des LAP classiques ont été décrites après surexpression de RARA suite à une insertion virale. Des études antérieures suggèrent que la répression transcriptionnelle joue un rôle dans l’immortalisation. Nous cherchons à comprendre quels sont les mécanismes moléculaires de la répression et quelle est la nature des cibles d’aval impliquées dans l’acquisition de l’auto-renouvellement et le blocage de la différenciation.
Nous menons deux approches en parallèle. L’une utilise des modèles murins de LAM dans lesquels le gène Pml a été inactivé. Celles-ci présentent un blocage de la réponse à la chimiothérapie conventionnelle, associé à une absence de sénescence induite par le traitement. L’autre modèle explore la réponse transcriptionnelle en cellule unique directement chez les patients. Ces approches, convergentes, permettent d’aborder les réseaux de gènes et les cascades de signalisation mobilisées en réponse à la chimiothérapie conventionnelle.
Membres de l’équipe de Hugues de Thé
Majdouline Abou-GhaliPost-doctorantePaolo AyakaDoctorantCaroline BerthierIngénieur d’étude, Collège de FranceThassadite DiramiIngénieur de recherche, UPCCécile EsnaultCRCN, INSERMOmar FerhiIngénieur d’étude, INSERMMarie-Claude GeoffroyCRHC, CNRSWissem HamelIngénieur contractuelleMichiko KawatikaIngénieur de recherche, UPCHao LiangIngénieur contractuelAdèle MarmuseDoctoranteHassane SoilihiTechnicien, CNRSHugues de ThéProfesseur, Collège de FranceYi ZhangPost-doctorantHsinchieh WuPost-doctorantePublications scientifiques
Pierre Bercier & al, Cancer Discover. 2023
Structural Basis of PML-RARA Oncoprotein Targeting by Arsenic Unravels a Cysteine Rheostat Controlling PML Body Assembly and FunctionLire la publicationHsin-Chieh Wu & al, Cancer Discover. 2021
Actinomycin D Targets NPM1c-Primed Mitochondria to Restore PML-Driven Senescence in AML TherapyLire la publicationAnthony Letai, Hugues de The, Nat Rev Cancer, 2025
Conventional chemotherapy: millions of cures, unresolved therapeutic indexLire la publicationSuivez nos actions en vous inscrivant à la lettre d'information de l’institut
- Découvrir l’Institut
- Recherche translationnelle
- Notre recherche clinique
- Essais cliniques
- Être soigné et accompagné
- Un nouvel Institut Hospitalo-Universitaire